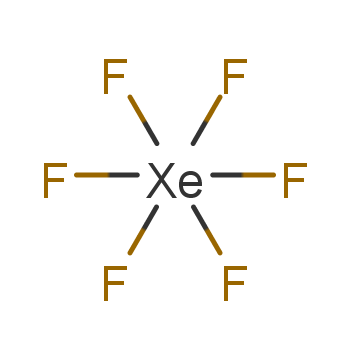
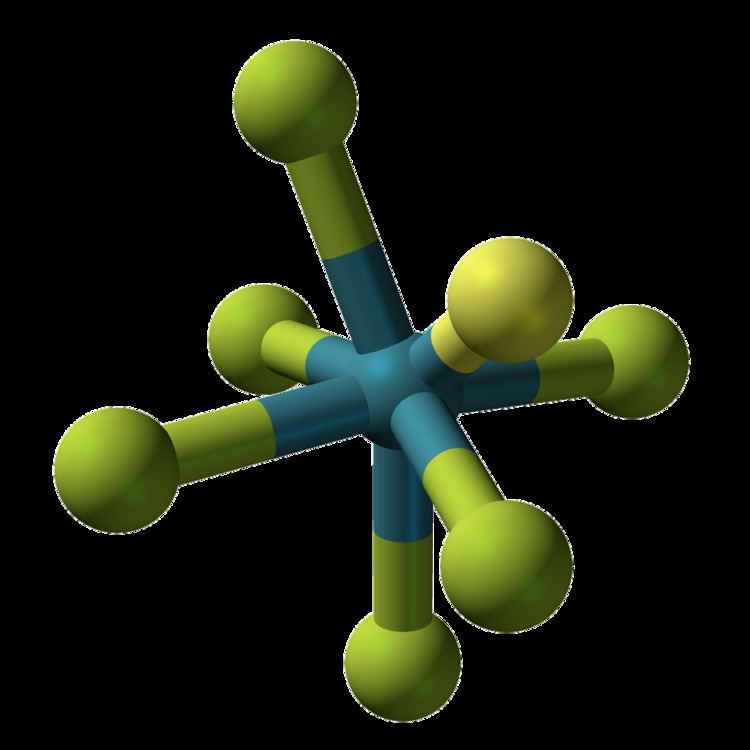
Xenonhexafluorid ist eine chemische Verbindung aus der Gruppe der Edelgasverbindungen. Es ist ein farbloser Feststoff.
Herstellung
Alle Xenonfluoride werden durch thermische oder photochemische Aktivierung von Xenon/Fluor-Gemischen hergestellt. Welches Produkt entsteht, hängt vom Stoffmengenverhältnis sowie den Reaktionsbedingungen ab (Druck, Temperatur). So kann Xenonhexafluorid durch langandauerndes Erhitzen von Xenon mit starken Fluor-Überschuss (1:20) bei 300 °C und einem Druck von 200–300 bar gewonnen werden.
Die Aufreinigung kann durch Zersetzung von Dinatriumfluoroxenat(VI) bei 120 °C erfolgen.
Eigenschaften
Physikalische Eigenschaften
Das Molekül ist in der Gasphase verzerrt oktaedrisch aufgebaut, wobei der Xenon-Fluor-Abstand im gasförmigen Zustand 189 pm beträgt. Im festen Zustand besteht Xenon(VI)-fluorid aus - und -Ionen, welche zu tetrameren oder hexameren Ringen verbrücken. Bei tiefen Temperaturen bildet die Verbindung in nicht-ionisierenden Medien gelöst ebenfalls Tetramere aus. Die gelbgrüne Schmelze der Verbindung setzt sich neben den Tetrameren auch aus Monomeren zusammen und besitzt eine geringe Eigenleitfähigkeit. Die eintretende Gelbfärbung während der Erhitzung ist reversibel, sodass der Festkörper nach dem Erkalten der Schmelze wieder farblos ist.
Chemische Eigenschaften
Xenonhexafluorid ist von allen Xenonfluoriden die am stärksten oxidierende Verbindung und konnte bisher nicht weiter oxidiert werden. Es reagiert sowohl als Fluorid-Akzeptor als auch -Donator. Im Allgemeinen reagiert die Verbindung mit Metallfluoriden des Typ wie Antimonpentafluorid als Donator.
Mit Alkalimetallfluoriden reagiert Xenon(VI)-fluorid dagegen als Akzeptor zu sechswertigen Fluoroxenaten, von denen die Salze der höheren Homologe mit dem zweifach negativen Anion die höchste Stabilität besitzen.
Xenonhexafluorid hydrolysiert schrittweise unter Bildung von Xenontrioxid.
Verwendung
Durch Hydrolyse kann Xenonoxytetrafluorid hergestellt werden.
Einzelnachweise